La generación de enzimas por medio de la evolución dirigida, para crear biocombustibles y productos farmacéuticos; el desarrollo de anticuerpos que pueden combatir enfermedades autoinmunes y, en algunos casos, curar el cáncer metastásico, son parte de los avances científicos que el premio Nobel de Química condecoró en su edición 2018.
El reconocimiento se concedió este miércoles a la estadounidense Frances H. Arnold, de 62 años, profesora del Instituto de tecnología de California (Caltech); el también norteamericano George P. Smith, de 77 años, profesor en la Universidad de Misuri; y el británico Gregory P. Winter, de 67, de la Universidad de Cambridge.
LEA MÁS: Curiosidades y otros datos históricos sobre el premio Nobel de Química
La decisión de otorgar el galardón al trabajo de estos científicos, se sustentó principalmente “(...) por la manera en que han tomado control de la evolución” y a su vez, por ejercer este dominio "para el mayor beneficio de la humanidad”, según indicó la organización en un comunicado de prensa.
“Los laureados de este año del premio Nobel de Química, han sido inspirados por el poder de la evolución y utilizan los mismos principios -cambio genético y selección- para desarrollar proteínas que solucionan los problemas químicos de la humanidad”, señaló la Real Academia Sueca, encargada de otorgar la condecoración.
“Han replicado los principios de Darwin en probeta. Se han basado en la comprensión de la molécula, que extraemos de los procesos de la evolución, para recrearlos en el laboratorio”, dijo a la de prensa el titular del comité Nobel del premio, Claes Gustafsson.
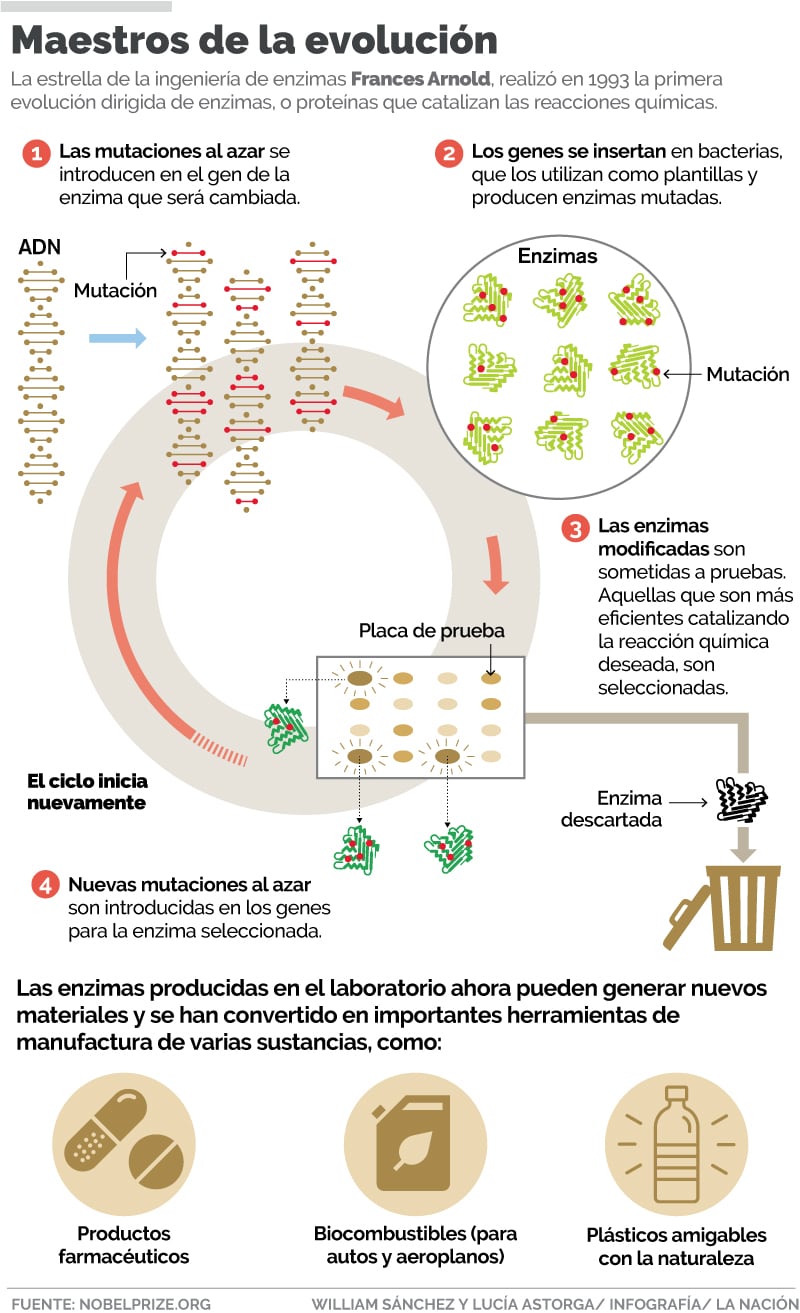
La evolución dirigida se entiende como un conjunto de tecnologías que permiten mejorar una proteína o un ácido nucleico al reproducir artificialmente el proceso natural de la evolución, aunque lo orientan a una dirección elegida.
Enzimas: herramientas de la vida
Beneficiar a la humanidad, a través del desarrollo de nueva tecnología, eso es lo que se propuso alcanzar Frances H. Arnold, desde que estaba recién graduada en ingeniería mecánica y aeroespacial.
“Estaba claro que una nueva forma de crear los materiales y productos químicos que necesitamos en nuestra vida cotidiana, sería posible gracias a la capacidad de volver a escribir el código de la vida", expresó. Esto explica que a principios de los años 80 colocara su atención en el ADN.
En lugar de producir fármacos, plásticos y otras sustancias, por medio de procesos químicos tradicionales, que frecuentemente requieren de fuertes solventes, metales pesados y ácidos corrosivos, Arnold se planteó usar las herramientas químicas de la vida: las enzimas.
Estas moléculas catalizan las reacciones químicas que ocurren en los organismos terrestres, por lo que si aprendía a diseñar nuevas enzimas, estaría ante un cambio radical en este campo de la ciencia.
Cuando comenzó a explorar esta inquietud, la científica hizo lo mismo que muchos de sus colegas en aquella época, aplicar una aproximación racional para reconstruir las enzimas y darles nuevas propiedades, sin embargo, las enzimas son moléculas extremamente complejas, construidas a partir de 20 diferentes tipos de aminoácidos, cuya combinación puede ser infinita.
“Usar la lógica para tratar de averiguar cómo esta arquitectura elaborada debe ser remodelada para dar nuevas propiedades a una enzima, es difícil, incluso con el conocimiento actual y la potencia de las computadoras. A principios de 1990, humilde ante la superioridad de la naturaleza, Francis Arnold decidió abandonar, en sus palabras, este “enfoque algo arrogante” y en su lugar se inspiró en el método propio de la naturaleza para optimizar la química: la evolución”, explicó la Real Academia Sueca.
Por mucho tiempo, la investigadora intentó cambiar una enzima llamada subtilisina, para catalizar reacciones químicas en un solvente orgánico, denominado dimetilformamida, en lugar de una solución a base de agua. Seguidamente, logró crear mutaciones en el código genético de las enzimas, para luego introducir estos genes mutados adentro de una bacteria. El fin era producir miles de variantes diferentes de subtilisina,
La siguiente etapa del proceso consistió en averiguar cuál de todos los posibles resultados, funcionaba mejor en un solvente orgánico. En la evolución natural esto se llamaría supervivencia del más apto, pero en esta etapa se le conoce como selección.
“Con esto Arnold logró demostrar el poder de permitir que el azar y la selección dirigida, en lugar de solamente la racionalidad humana, gobierne sobre el desarrollo de nuevas enzimas. Este fue el primer y más decisivo paso hacia la revolución que estamos presenciando”, explicó la organización de los Nobel.
Estos estudios fueron continuados por el investigador y empresario holandés Willem P. C. Stemmer, quien falleció en 2013, al introducir una nueva dimensión, por medio del apareamiento en un tubo de ensayo.
En 1994 pudo demostrar que era posible cortar en pequeñas piezas, diferentes versiones de un gen, y luego, con la ayuda de la tecnología del ADN, fusionar las piezas en un gen completo, uno que sea un mosaico de las versiones originales.
Usando varios ciclos de mezcla de ADN, Stemmer cambió una enzima para que se volviera mucho más efectiva que la enzima original. Esto demostró que los genes de apareamiento juntos (los investigadores llaman a esto recombinación), pueden resultar en una evolución aún más eficiente de las enzimas.
Las enzimas producidas en el laboratorio de Arnold, pueden ‘catalizar química’ que ni si quiera existe aun en la naturaleza, produciendo nuevos materiales, también se han convertido en herramientas de gran importancia para la manufactura de varias sustancias como las de uso farmacéutico.
Asimismo, sus investigaciones han permitido acelerar las reacciones químicas, producir menos subproductos y, en algunos casos, ha sido posible excluir los metales pesados requeridos por la química tradicional, lo que reduce considerablemente el impacto ambiental.
La científica ahora enfoca sus esfuerzos en la energía renovable. Su grupo de investigación ha desarrollado enzimas que transforman los azúcares simples en isobutanol, una sustancia rica en energía que se puede usar para la producción de biocombustibles y plásticos más amigables con el ambiente.
Desarrollo de nuevas proteínas
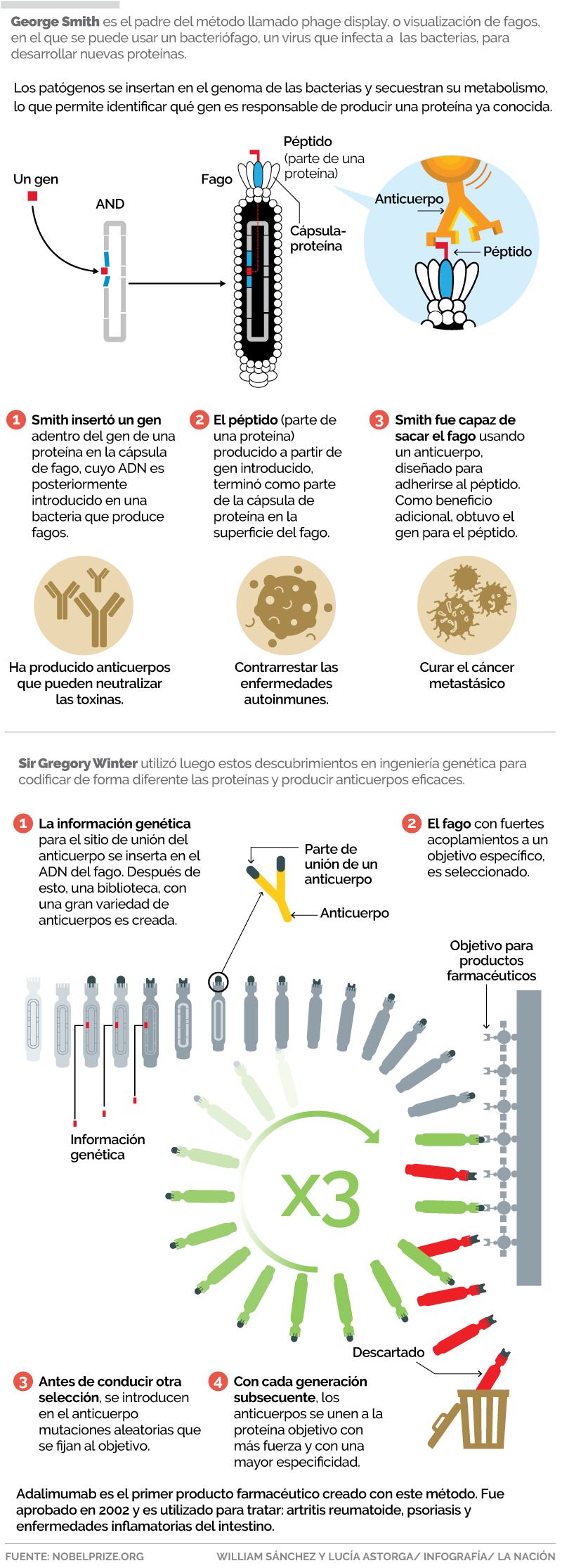
En la primera mitad de 1980, George Smith empezó a utilizar los bacteriófagos, se trata de pequeños pedazos de material genético que está encapsulado en proteínas protectoras. Cuando se reproducen, inyectan su material genético en las bacterias y secuestran su metabolismo.
Las bacterias producen nuevas copias del material genético del fago y de las proteínas que forman la cápsula, que a su vez forman nuevos fagos.
Smith pensaba que los investigadores deberían usar las ‘simples’ construcciones de los fagos para encontrar un gen desconocido, de una proteína conocida. Para este momento, grandes bibliotecas moleculares estaban disponibles, las cuales contenían masas de fragmentos de varios genes desconocidos.
Su idea era juntar estas piezas con el gen para una de las proteínas en la cápsula del fago. Cuando se produjeron nuevos fagos, las proteínas del gen desconocido terminarían en la superficie del fago como parte de la proteína de la cápsula.
Originando así una mezcla de fagos, que transportaban multitudes de diferentes proteínas en su superficie. En la siguiente etapa, postulada por George Smith, los investigadores podrían usar anticuerpos para pescar fagos que llevan varias proteínas conocidas de esta ‘sopa’.
“Los anticuerpos son proteínas que funcionan como misiles dirigidos; pueden identificar y unirse a una única proteína entre decenas de miles de otras con extrema precisión. Si los investigadores detectaran algo en la sopa de fagos utilizando un anticuerpo que sabían que estaba unido a una proteína conocida, como captura incidental obtendrían el gen hasta ahora desconocido de la proteína”, indicó la Real Academia.
En 1985 Smith creó un fago que llevaba parte de una proteína, un péptido, en su superficie. Al emplear un anticuerpo, entonces fue capaz de pescar el fago que había construido fuera del resto de fagos.
Por medio de este experimento, este científico sentó las bases de lo que se conoce como visualización de fagos (phage display).
El otro gran avance para este procedimiento se produjo cerca de 1990, cuando varios grupos investigadores empezaron a utilizar la visualización de fagos para desarrollar biomoléculas. Una de las personas en adoptar esta técnica fue Gregory Winter y es gracias a él que esta técnica está ofreciendo grandes beneficios.
Anticuerpos: bloqueadores de enfermedades
Los anticuerpos son altamente selectivos y se pueden unir a una sola molécula, entre miles de estas. Por mucho tiempo la esperanza de los investigadores, fue diseñar anticuerpos que bloquearan en el cuerpo varias enfermedades y que funcionaran como fármacos.
Al principio, para obtener estos anticuerpos terapéuticos, se utilizaban ratones, que eran inyectados con diferentes objetivos para productos farmacéuticos, como proteínas de células cancerígenas.
“Sin embargo, en 1980 se volvió claro que este método tenía sus limitaciones; algunas sustancias eran tóxicas para el ratón y otras no resultaban en ninguna producción de anticuerpos. Adicionalmente, se descubrió que los anticuerpos obtenidos eran considerados por el sistema inmunológico del paciente, como objetos extraños, por lo cual eran atacados. Esto provocaba que los anticuerpos de los ratones fueran destruidos y que hubiera riesgo de efectos secundarios para los pacientes”, explicó la organización de los Nobel.
Para sobrepasar este obstáculo, Winter comenzó a investigar el potencia de la visualización de fagos, para evitar el uso de los ratones y ser capaz de basar los productos farmacéuticos en los anticuerpos de los seres humanos, ya que estos pueden ser tolerados por nuestro sistema inmunológico.
Los anticuerpos son moléculas en forma de Y; el extremo lejano de cada brazo se adhiere a sustancias extrañas, lo que fue aprovechado por Winter, para unir la información genética de estas secciones, al gen de las cápsulas de proteína de los fagos.
En 1990 demostró que esto llevaba a que el sitio de unión del anticuerpo terminara en la superficie del fago.
El anticuerpo que usó, fue diseñado para ligarse a una pequeña molécula conocida como phOx, la cual funcionaba como un tipo de gancho molecular para pescar. Winter tuvo éxito en extraer el fago con el anticuerpo en su superficie, a partir de una sopa de otros cuatro millones de fagos.
Así, fue capaz de crear una biblioteca compuesta de fagos, con millones de variedades de anticuerpos en su superficie, de esta colección pudo pescar anticuerpos que se vinculaban a diferentes proteínas diana (que son el blanco de algo).
Luego, cambió al azar su primera generación de anticuerpos y generó una nueva biblioteca, por medio de la cual obtuvo anticuerpos con una fijación todavía más fuerte; por ejemplo, en 1994 implementó este método para desarrollar anticuerpos que se unieron a las células de cáncer con mayor especificidad.
Winter tomó este método y fundó una empresa junto a sus colegas, la cual desarrolló en 1990 un producto farmacéutico, completamente basado en anticuerpos humanos, el cual neutraliza la proteína TNF-alpha, que impulsa la inflamación en muchas enfermedades autoinmunes: el adalimumab.
En el 2002 el producto fue aprobado para ser utilizado en el tratamiento de artritis reumatoide y ahora también se receta para tratar diferentes tipos de psoriasis y enfermedades que generan inflamación en el intestino.
El método de visualización de fago también se ha empleado para producir anticuerpos para el cáncer; uno de estos libera las ‘células asesinas’ del cuerpo para que puedan atacar a las células tumorales, disminuyendo el crecimiento de estas masas, y, en algunos casos, puede curar a pacientes con cáncer metastásico, lo cual es considerado como un avance histórico en el tratamiento de esta enfermedad.
Así mismo, se ha aprobado el uso de un anticuerpo que neutraliza la toxina bacteriana que causa ántrax, y otro reduce el avance de la enfermedad autoinmune conocida como lupus; muchos más anticuerpos están actualmente en ensayos clínicos, por ejemplo, para combatir el alzhéimer.